Popularne
Komunikat pyłkowy
Kraków, na dzień: 20.10.2025 r.
| takson | stężenie | prognoza |
|---|---|---|
| alternaria | ||
| cladosporium |
Komunikat opracowany przez Krakowską Stację Monitoringu Aerobiologicznego przy Zakładzie Alergologii Klinicznej i Środowiskowej UJCM.
| stężenie | |
|---|---|
| niskie | średnie |
| wysokie | bardzo wysokie |
Komunikat pyłkowy
Kraków, na dzień: 20.10.2025 r.
| takson | stężenie | prognoza |
|---|---|---|
| alternaria | ||
| cladosporium |
Komunikat opracowany przez Krakowską Stację Monitoringu Aerobiologicznego przy Zakładzie Alergologii Klinicznej i Środowiskowej UJCM.
| stężenie | |
|---|---|
| niskie | średnie |
| wysokie | bardzo wysokie |
Jakość powietrza
Nobel 2019 z medycyny, czyli jak nasze komórki radzą sobie ze zmianami stężenia tlenu w otoczeniu
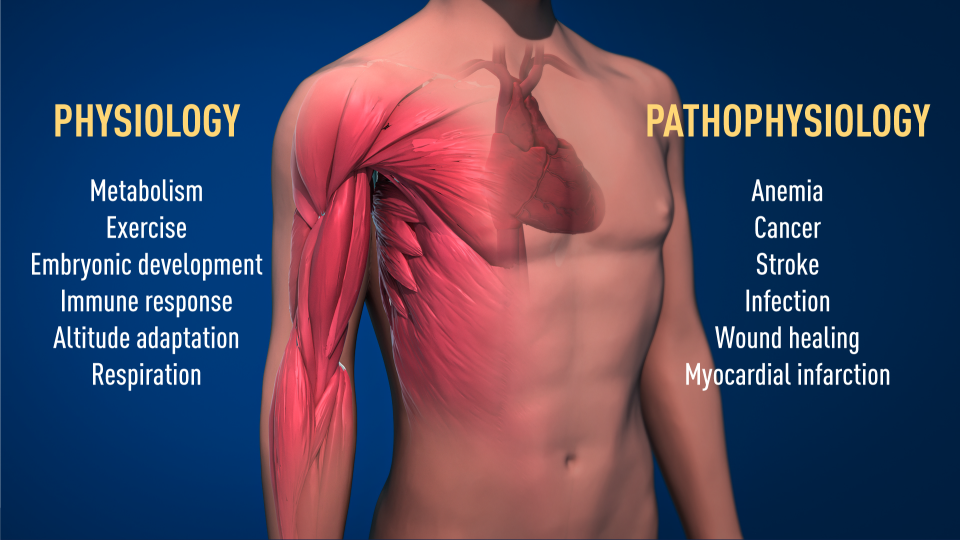
Należymy do organizmów, których istnienie jest ściśle/bezwzględnie uzależnione od dostępu/obecności tlenu. W prawidłowo przebiegającym procesie oddychania tkankowego z udziałem tlenu organizm zdobywa kilkunastokrotnie (15-,16-krotnie) więcej energii w wyniku całkowitego utlenienia najbardziej podstawowego metabolitu, jakim jest glukoza, niż wówczas, gdyby spalał go bez jego udziału. Trudno więc sobie wyobrazić życie, jakie znamy, bez obecności wystarczających ilości tlenu.
Nic wiec dziwnego, że Instytut Karoliński w Sztokholmie – który przyznaje nagrodę Nobla w dziedzinie fizjologii i medycyny – nie po raz pierwszy zwraca uwagę na wyniki badań poświęconych metabolizmowi tlenowemu i nagradza uczonych, którzy dokonali ważnych/przełomowych odkryć. Nie sposób nie wspomnieć choćby laureata Nagrody Nobla z 1931 r. Otto Warburga, nagrodzonego za badania nad strukturą i funkcjonowaniem enzymów oddechowych, czy Hansa Krebsa, który otrzymał nagrodę w 1953 r. za odkrycie ciągu przemian zachodzących w związanych z oddychaniem tlenowym organellach komórkowych (mitochondria), nazwanych dla upamiętnienia odkrywcy cyklem Krebsa. Na krótkie choćby wspomnienie zasługują również Otto Friz Meyerhoff (fizjologia i medycyna, tlenowy metabolizm mięśniowy; 1922), Peter Mitchell (chemia, teoria chemiosmotyczna; 1978) czy Paul D. Boyer i John E. Walker (chemia, synteza ATP; 1997).
Charakterystyczną cechą organizmów wielokomórkowych jest więc złożony metabolizm tlenowy, który pozwala na uzyskanie energii niezbędnej do przeżycia. Wszelkie zaburzenia jego funkcjonowania, a także zmiany – zazwyczaj zmniejszenie jego dostępności, jak choćby np. pobyt na dużych wysokościach – generują zagrożenie dla zdrowia i życia. Stan niedotlenienia – nazywany hipoksją – i wszelkie z tego wynikające niekorzystne konsekwencje dla organizmu towarzyszą niedokrwistościom (anemiom), zawałowi mięśnia sercowego, krwotocznemu lub niekrwiennemu udarowi mózgu, licznym i rozmaitym stanom zapalnym, infekcjom czy wreszcie nowotworom. W związku z powyższym, niezwykle istotne znaczenie mają mechanizmy adaptacyjne, które pozwalają komórkom odpowiedzieć na zaburzenia homeostazy (równowagi) tlenowej poprzez stymulację produkcji energii (ATP) w procesie glikolizy beztlenowej lub poprzez przywrócenie prawidłowego utlenowania tkanek.
Zaburzenia homeostazy tlenowej są szczególnie widoczne w komórkach nowotworowych, które charakteryzują się intensywną proliferacją oraz względnie słabym lub funkcjonalnie upośledzonym unaczynieniem.
Badania prowadzone przez Gregga Semenzę i Sir Petera Ratcliffe’a nad genem erytropoetyny – hormonu, który jest syntezowany przy ekspozycji organizmu na niskie ciśnienie tlenu (np. wysokie góry) w celu poprawy jego utlenowania – doprowadziły do zidentyfikowania ogólnoustrojowego mechanizmu reakcji komórek organizmu na zmniejszoną obecność tlenu. Równocześnie badania Williama Kaellina nad dziedziczną chorobą von Hippel-Lindau i genem warunkującym jej powstawanie, a także powiązania jego mutacji z rozwojem nowotworów ujawniły zwiększoną aktywność enzymów i szlaków sygnalizacyjnych uruchamianych przez HIF-1 w odpowiedzi na hipoksję. Tym samym poznany został zależny od tlenu mechanizm regulacji działania HIF-1.
Połączenie tych faktów i zestawienie ze sobą wniosków przełomowych prac pokazało, że odkryta ścieżka sygnalizacyjna z udziałem czynnika uaktywniającego się w warunkach niedotlenienia (HIF-1) pozwala komórkom przetrwać w warunkach ograniczonego dostępu do tlenu. W przypadku komórek nowotworowych stan ten prowadzić może do selekcji komórek opornych na hipoksję, które w znaczący sposób mogą przyczyniać się do progresji nowotworu i oporności na terapię. Nasilone hipoksją mechanizmy adaptacyjne obserwowane w rozwoju i progresji większości nowotworów stanowią dziś uniwersalny cel terapii antynowotworowej i mogą okazać się bardzo istotne w leczeniu onkologicznym, ale również wspomnianej wyżej anemii i innych schorzeń.
Tak więc, choć już same odkrycia tegorocznych laureatów nagrody Nobla w dziedzinie fizjologii i medycyny zasługują na najwyższe uhonorowanie, to ich medyczne implikacje, częściowo analizowane i badane, otwierają dalsze obszary poszukiwań mechanizmów funkcjonowania metabolizmu tlenowego i ich wykorzystania w terapii.

Laureaci nagrody Nobla 2019 w dziedzinie medycyny i fizjologii; od prawej: Gregg L. Semenza (ur. 1956 r. w Nowym Jorku) związany jest z Johns Hopkins University w Baltimore; Sir Peter J. Ratcliffe (ur. 1954 r. w angielskim Lancashire) pracuje na Uniwersytecie Oksfordzkim oraz we Francis Crick Institute w Londynie; William G. Kaelin Jr. (ur. 1957 r. w Nowym Jorku) pracuje w Harvard Medical School w Bostonie oraz w Howard Hughes Medical Institut w Chevy Chase
Cukrzyca ciążowa – problem, który nie kończy się po porodzie
17 listopada 2025
Dlaczego GDM jest tak istotna? Ciąża to czas ogromnych...

Rowerem po zdrowie
12 sierpnia 2024
Z prof. dr hab. Grażyną Jasieńską z Zakładu Zdrowia i Środowiska Instytutu...

Sztuczna inteligencja w medycynie
30 stycznia 2024
AI w medycynie to otwarte wykłady poświęcone różnym aspektom...
Popularne
Komunikat pyłkowy
Kraków, na dzień: 20.10.2025 r.
| takson | stężenie | prognoza |
|---|---|---|
| alternaria | ||
| cladosporium |
Komunikat opracowany przez Krakowską Stację Monitoringu Aerobiologicznego przy Zakładzie Alergologii Klinicznej i Środowiskowej UJCM.
| stężenie | |
|---|---|
| niskie | średnie |
| wysokie | bardzo wysokie |
Komunikat pyłkowy
Kraków, na dzień: 20.10.2025 r.
| takson | stężenie | prognoza |
|---|---|---|
| alternaria | ||
| cladosporium |
Komunikat opracowany przez Krakowską Stację Monitoringu Aerobiologicznego przy Zakładzie Alergologii Klinicznej i Środowiskowej UJCM.
| stężenie | |
|---|---|
| niskie | średnie |
| wysokie | bardzo wysokie |
